FÓRMULAS
Concentração é o quociente entre a massa do soluto e o volume da
solução.
Sua fórmula é
dada por C = m1/V(g/L)
Exemplo 1: Havendo
20g em 1 litro de solução: neste caso, diremos que a concentração será:
C = m1/V =
20/1 = 20 g/L
Exemplo 2: Havendo
60g de NaCl em 3 litros de solução: a concentração, neste caso, será:
C = m1/V =
60/3 = 20 g/L
Observação: não confunda
concentração (C) com densidade (d) da solução.
Densidade é o quociente entre a massa da solução e seu volume.
Sua fórmula é
expressa em: d = m/V (g/mL)
Observação: sempre que o volume for
dado em litros, transforme-o para mililitros
Exemplo 1: 6,0 L de uma solução tem
massa de 20 g. A densidade desta solução é de:
d
= m/V = 20 /6 = 20/6000 = 0,003 g/mL
Título ou porcentagem em massa (T) é quociente entre a massa do soluto e massa total da solução.
T =
m1/m ou m1/m1+m2
x 100 ;
Observe a figura abaixo, em que é
dada a porcentagem em massa do cloreto de sódio de uma solução de soro
fisiológico:
O
soro fisiológico, usado no tratamento de desidratação, contém uma porcentagem
em massa de cloreto de sódio de 0,9%
Nesse
caso, significa que em cada 100 g ou 100 unidades dessa solução, há 0,9 g ou
0,9% de soluto, isto é, do cloreto de sódio (NaCl – sal de cozinha).
Outro
exemplo é o vinagre: no seu rótulo há indicação de que na sua preparação foram
usados 5% de massa de ácido acético, ou seja, existem 5 g desse ácido para cada
100 g de solução.
O Título pode ser dado também em porcentagem
de volume. Nesse caso, a única diferença é que no lugar de relacionar a
massa do soluto com a massa da solução; relaciona-se o volume do soluto com o
volume da solução, segundo a fórmula a seguir:
Por
exemplo, no caso do álcool comum, que apresenta uma porcentagem em volume de
96%, em 100 mL da solução, 96 mL é álcool.
O termo “Título” é mais usado entre os
cientistas, já os técnicos e vários autores de livros usam mais a expressão
“Porcentagem em massa”.
Título em Volume
de uma Solução Química
A lei estabelece que o limite máximo de etanol adicionado à gasolina é
de 24 % (porcentagem em volume).
No texto “Título ou Porcentagem em Massa” nós vimos como calcular a relação
entre a massa do soluto e a massa da solução, para soluções sólidas, líquidas e
gasosas. Neste texto, porém, veremos que também é possível calcular o título em
termos de volume, para soluções com componentes líquidos ou gasosos.
O título em volume pode ser calculado
pela expressão:
Considere como exemplo uma solução
aquosa de álcool etílico usada como antisséptico e desinfetante, que foi
preparada adicionando-se 70 mL de álcool puro à água suficiente para completar
um volume de 100 mL de solução. Assim, temos:
Podemos expressar o título em
porcentagem também, apenas multiplicando o resultado por 100%. Portanto, nesse
caso temos uma solução de álcool etílico a 70%, o que significa que, de cada
100 unidades de volume da solução, 70 unidades de volume são de álcool.
No caso abaixo, temos uma solução de álcool etílico a
70% em um volume de 250 mL de solução; o que quer dizer que 175 mL são de
álcool, conforme os cálculos:
100 mL -------
70 mL de álcool
250 mL ------- X
X = (250x70)/100
X = 175 ml de
álcool
No entanto, não podemos dizer que
temos nesse caso 75 mL (250-175) de água. Diferentemente do título em massa, no
qual podemos somar a massa do solvente com a massa do soluto para encontrar a
massa da solução, isso não pode ser feito em relação ao título em volume.
Isso significa que o volume da
solução não é igual à soma do volume do solvente com o volume do soluto (embora
muitas vezes a diferença possa ser considerada desprezível). Isso ocorre porque
as forças intermoleculares que existem nesses líquidos influenciam no volume
final.
No caso da solução citada, de álcool
etílico, por exemplo, quando misturamos o álcool com a água, ocorre uma
contração do volume total da solução; ou seja, o volume final será menor do que
se somássemos o volume do álcool e da água isolados. Isso se dá porque as
moléculas de álcool estabelecem ligações ou pontes de hidrogênio com as
moléculas da água, diminuindo os espaços entre elas.
Portanto, nesse e nos outros casos,
o volume da solução deve ser medido experimentalmente quando não forem
fornecidos no exercício.
A porcentagem em volume é muito
utilizada em casos de bebidas alcoólicas e no álcool comercial, como o
mencionado. Veja duas aplicações importantes desse cálculo:
Bafômetro: o
bafômetro mede a concentração de álcool etílico no sangue, sendo que no Brasil
é proibido alguém conduzir qualquer tipo de veículo com teor alcoólico
sanguíneo igual ou acima de 0,1 % em volume. Uma pessoa com esse teor alcoólico
apresenta, para cada litro de sangue, 1 mL de álcool, conforme mostrado pelos
cálculos a seguir:
τv%=V1.100%
v
v
0,1%=V1.100%
1L
1L
V1 = 0,1% →V1 =0,001L=1mL
100%
Teor de etanol
na gasolina: No
Brasil, a gasolina recebe de forma regulamentada a adição de etanol. Mas o teor
de etanol na gasolina deve ser de no máximo 24% em volume de álcool anidro (já
que a gasolina deve ser isenta de água). Quanto mais etanol é adicionado à
gasolina, mais a cor do combustível vai clareando e sua densidade aumentando.
Fração
Molar
A fração molar é um número adimensional (sem unidade de grandeza) que relaciona a parte
de uma mistura com o total. É frequentemente utilizada para indicar a
porcentagem molar de uma substância imersa
em um solvente –
número de mol do soluto dividido pelo número de mol da solução (soluto
+ solvente); assim como em balanços de massa.
Vale lembrar que a soma
das frações molares de todos os componentes de uma mistura deve ser sempre
igual a 1.
Exemplo:
Uma solução de NaCl foi preparada a partir de 250mL de água pura destilada e
12g do soluto. Calcular a fração molar do sal na solução.
Primeiramente, deve-se
calcular o número de mol do NaCl dividindo-se a massa adicionada à solução pela
massa molar:
Em seguida, calcula-se o número de
mol de H2O contidos em 250mL (250g):
Assim,
a fração molar do soluto é:
Molaridade
A molaridade representa a concentração de alguma substância (em
mols) numa solução, considerando apenas o volume do solvente. Assim, é um número dimensional
(mol/l) e não deve ser confundido com a fração molar (relação mol/mol), apesar
da semelhança de nomenclatura.
Exemplo: Calcular a concentração de íons H+ de uma solução de pH igual a 8:
Sendo pH = -log[H+], onde [H+] é a concentração de
íons H+:
8 = -log[H+], utilizando-se das propriedades dos logaritmos:
[H+] = 10-8 M
Assim, cada litro de solução possui 10-8 mols de H+.
Molalidade
Molalidade ou concentração molal é a relação entre o número de mol do soluto (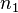 ) e a massa do solvente (
) e a massa do solvente (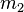 ), em quilogramas (kg) (não pode ser expressa em outra unidade).
), em quilogramas (kg) (não pode ser expressa em outra unidade).
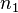 ) e a massa do solvente (
) e a massa do solvente (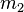 ), em quilogramas (kg) (não pode ser expressa em outra unidade).
), em quilogramas (kg) (não pode ser expressa em outra unidade). ou
ou 
Sendo:  = molalidade ou concentração molal
= molalidade ou concentração molal 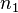 = número de moles do soluto
= número de moles do soluto 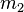 = massa do solvente em quilogramas
= massa do solvente em quilogramas
 = molalidade ou concentração molal
= molalidade ou concentração molal 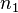 = número de moles do soluto
= número de moles do soluto 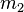 = massa do solvente em quilogramas
= massa do solvente em quilogramas
Exemplo de Cálculo
Uma solução é preparada dissolvendo-se 4,250 g de NaNO3 em 2000 g de água. Qual a molalidade da solução? (Dado: Na = 23 u; N = 14; O = 16)
Reunindo os dados, e chamando de  a massa do soluto e
a massa do soluto e 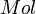 a massa molar do soluto, temos que:
a massa molar do soluto, temos que:
 a massa do soluto e
a massa do soluto e 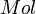 a massa molar do soluto, temos que:
a massa molar do soluto, temos que:

A massa molar do NaNO3 é soma das massas molares dos elementos, ou seja:
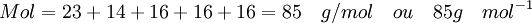
A partir daí, podemos calcular então o número de mol do soluto:

Aplicando a fórmula da molalidade, temos:
 ]
]
Normalidade
A normalidade é uma forma de expressar a concentração de uma solução. A normalidade indica o
número de equivalentes-grama do soluto em 1 (um)
litro de solução. Esta é calculada através do quociente entre o número de
equivalente-grama (eg) de soluto dissolvidos
e o volume de solução em
litros.
Para entender
melhor a razão de existir a normalidade, é necessário conhecer a quarta lei ponderal da química, a Lei de
Richter.
Quarta lei
ponderal da Química ou Lei de Richter: "As
substâncias, em uma reação química, reagem entre si, equivalente a
equivalente."
O cálculo do número de
equivalentes-grama (eg) é dado pela fórmula abaixo, onde eg é o número de
equivalentes-grama e V é o volume em
litros.
O
equivalente-grama de uma substância ou de um elemento varia
conforme o meio em que se encontra. Exemplos:
§ O elemento, sozinho, tem seu equivalente-grama expresso pela seguinte
relação: é a massa molar do elemento dividida pela carga total
real ou aparente (nox).
§ Na reação acido-base,
o equivalente-grama de um ácido é a
quantidade de matéria (mol) de H+ que é ionizada na reação. E
para a base é
a quantidade de matéria (mol) de OH- que é ionizada na reação
fursbi.
§ Em uma reação de oxi-redução,
o equivalente-grama de um sal é
representado pela variação de nox do redutor ou do oxidante.
§ Em um ácido
carboxílico, o equivalente-grama é a massa molar do ácido dividida
pelo número de carboxilas deste, pois o hidrogênio ionizável do
ácido orgânico está presente na hidroxila do
grupo funcional carboxila.
§ Em um sal que não será utilizado em reações de oxi-redução, o
equivalente-grama se dá pela divisão entre a massa molar do sal pela carga
total do cátion ou do
ânion (se for considerar a carga total doânion, obviamente deverá ser seu módulo).
Equivalente-Grama.
Equivalente-grama (E) de um elemento químico é o
quociente da massa atômica (MA) pela valência (v) do elemento.
Para cada substância inorgânica existe uma maneira
diferente de calcular o equivalente grama:
-Ácidos: é o quociente da massa molar do ácido (M) pelo número de hidrogênios
ionizáveis (H+).
E
= M/num. de H+ (g)
Exemplo: H2SO4 → E
= 98/2 = 49
g
-Base: é o quociente da massa molar da base (M)
pelo número de hidroxila (OH-).
E
= M/num. de OH- (g)
Exemplo: Ca(OH)2 →
E = 74/2
= 37 g
-Sais: é o quociente da massa molar do sal (M)
pela valência total do cátion ou do ânion (val).
E
= M/val (g)
Exemplo: Al2(SO4)3 →
E = 342/6
= 57 g
-Oxidantes e Redutores: é o quociente da
massa molar da substância (M) pela variação total (∆) de seu número de oxidação.
E
= M/∆ (g)
Exemplo: SnCl2 à
SnCl4
∆ = 2
. 1 = 2
E = 190/2
= 95 g
Numero
de Equivalente-grama
É o quociente entre sua massa (Me) e seu
equivalente-grama (E).
e
= Me/E (eq-g)
Exemplos: Calcule o número de equivalentes-gramas
correspondente a 245 g de H2SO4
e = 245/9
= 5 eq-g
Concentração
Normal ou Normalidade (N):
É uma forma de expressar a concentração de uma solução. A normalidade indica
o número de equivalentes-gramas do soluto em 1 litro de solução. Esta é
calculada através do quociente entre o número de equivalente-grama (eq-g) de soluto dissolvidos e o volume de solução em litros.
N = e1/V (eq-g/L)
ALGUMAS RELAÇÕES
·
Relação entre Concentração comum e Título:
C = m1/V T = m1/m
C/T = m1/
V /
M1/m = m/V = d
C = T . d
Obs.: A
concentração sempre deve ser expressa em g/L
·
Relação entre Molaridade e Título
Mr = m1/M1.V T = m1/M
Mr/T = m1/M1.v / m1/M =
m/M1.v
Mr/T = m/M1.V
à M1.Mr / T = m/V à M1.Mr/T = d à M1.Mr = d . T
·
Relações entre
Concentração, Título e Molaridade
C = m1/V T = m1/m1+m2 Mr = n1/V
Mr = n1/V =
m1/ V.M1 = C/M1=T.1000.d/M1
·
Relação entre
Concentração comum e Molaridade
C = m1/V Mr =m1/M1.V
C/Mr
= m1/V / m1/M1.V = M1 à
C/Mr = M1 à
C = M1.MR
C
= d.T = M1.Mr
ALGUMAS RELAÇÕES
·
Relação entre Concentração comum e Título:
C = m1/V T = m1/m
C/T = m1/
V /
M1/m = m/V = d
C = T . d
Obs.: A
concentração sempre deve ser expressa em g/L
·
Relação entre Molaridade e Título
Mr = m1/M1.V T = m1/M
Mr/T = m1/M1.v / m1/M =
m/M1.v
Mr/T = m/M1.V
à M1.Mr / T = m/V à M1.Mr/T = d à M1.Mr = d . T
·
Relações entre
Concentração, Título e Molaridade
C = m1/V T = m1/m1+m2 Mr = n1/V
Mr = n1/V =
m1/ V.M1 = C/M1=T.1000.d/M1
·
Relação entre
Concentração comum e Molaridade
C = m1/V Mr =m1/M1.V
C/Mr
= m1/V / m1/M1.V = M1 à
C/Mr = M1 à
C = M1.MR
C
= d.T = M1.Mr
·
Relações entre
a normalidade e outras expressões de concentrações das soluções:
-Concentração comum (C) e normalidade (N):
C = N.E1
-Molaridade
(Mr) e normalidade (N):
M1.Mr = N.E1
-Concentração em quantidade de matéria
(Mr), concentração comum (C),
normalidade (N) e título em massa (T):
C = m1.Mr = N.E1 = 1000.T.d
Abaixo estão alguns exercícios respondidos para treinar:
EXERCÍCIO –
SOLUÇÕES
01. (FAAP)
Quais as massas de Na2CO3 e de água, necessárias para preparar 2 kg de uma
solução aquosa de carbonato de sódio de concentração igual a 0,5 molal?
02. (UFG) Qual é a molalidade de uma solução que contém 34,2 g de sacarose, C12H22O11, dissolvidos em 200 g de água? Dados: C = 12; H = 1; O = 16
a) 0,1 molal
b) 0,005 molal
c) 0,5 molal
d) 1,2 molal
e) 0,0005 molal
03. (PUCC) Se dissolvermos 40 g de hidróxido de sódio em 162 g de água, a quente, a fração molar do soluto será: Dados: Na = 23; O =16; H = 1
a) 0,2
b) 0,02
c) 0,1
d) 0,01
e) n.d.a.
04. (MED – POUSO ALEGRE) Concentração molal, é:
a) Equivalente-grama de soluto por litro de solvente;
b) Mol de soluto por litro de solvente;
c) Mol de soluto por 1 000 g de solvente;
d) 100 g de soluto por 1 000 g de solvente.
05. (ITA) Deseja-se calcular a fração molar do soluto de uma solução aquosa 0,50 molal desse soluto. Sabe-se que o peso molecular da água vale 18,0.
Qual é a melhor opção:
a) O cálculo somente será possível se for dado o peso molecular do soluto.
b) O cálculo somente será possível se forem dadas as condições de pressão e de temperatura.
c) O cálculo somente será possível se for dada a densidade da solução.
d) O cálculo somente será possível se for dada a fração molar do solvente.
e) Não falta nenhum dado para o cálculo pedido.
06. (UBERLÂNDIA) A concentração de ácido acético (C2H4O2) no vinagre é da ordem de 0,83 M. Aproximadamente, quantos gramas desse ácido há em 1 litro de vinagre? Dados: C = 12; H = 1; O =16
a) 10 g
b) 20 g
c) 30 g
d) 40 g
e) 50 g
07. (MED – ITAJUBA) Quantos gramas de Na3PO4 (PM = 164) são necessárias para preparar 5,0 litros de uma solução 3 molar?
a) 10,9
b) 65,6
c) 98,4
d) 273
e) 2460
08. (MED – POUSO ALEGRE) Para se preparar um litro de solução de KMnO4 0,1 N que deve atuar como oxidante em meio ácido, são necessários do sal: Dados: K = 39; Mn = 55; O =16
a) 15,8 g
b) 7,9 g
c) 31,6 g
d) 3,16 g
e) 1,58 g
09. (PUC) Foram totalmente dissolvidos em 100 ml de ácido clorídrico 6,54 gramas de zinco. Supondo não haver variação de volume da solução, qual é a molaridade da solução final em cloreto de zinco? Dado: Zn = 65,4
a) 0,1 M
b) 0,2 M
c) 1 M
d) 2 M
e) 10 M
10. (UFPR – UEMT) Uma solução aquosa de determinada concentração foi preparada a 20°C. Na temperatura de 60°C, a sua concentração será exatamente a mesma, somente se for expressa como:
a) normalidade
b) molaridade
c) molalidade
d) fração pondero-volumétrica
e) fração volumétrica
02. (UFG) Qual é a molalidade de uma solução que contém 34,2 g de sacarose, C12H22O11, dissolvidos em 200 g de água? Dados: C = 12; H = 1; O = 16
a) 0,1 molal
b) 0,005 molal
c) 0,5 molal
d) 1,2 molal
e) 0,0005 molal
03. (PUCC) Se dissolvermos 40 g de hidróxido de sódio em 162 g de água, a quente, a fração molar do soluto será: Dados: Na = 23; O =16; H = 1
a) 0,2
b) 0,02
c) 0,1
d) 0,01
e) n.d.a.
04. (MED – POUSO ALEGRE) Concentração molal, é:
a) Equivalente-grama de soluto por litro de solvente;
b) Mol de soluto por litro de solvente;
c) Mol de soluto por 1 000 g de solvente;
d) 100 g de soluto por 1 000 g de solvente.
05. (ITA) Deseja-se calcular a fração molar do soluto de uma solução aquosa 0,50 molal desse soluto. Sabe-se que o peso molecular da água vale 18,0.
Qual é a melhor opção:
a) O cálculo somente será possível se for dado o peso molecular do soluto.
b) O cálculo somente será possível se forem dadas as condições de pressão e de temperatura.
c) O cálculo somente será possível se for dada a densidade da solução.
d) O cálculo somente será possível se for dada a fração molar do solvente.
e) Não falta nenhum dado para o cálculo pedido.
06. (UBERLÂNDIA) A concentração de ácido acético (C2H4O2) no vinagre é da ordem de 0,83 M. Aproximadamente, quantos gramas desse ácido há em 1 litro de vinagre? Dados: C = 12; H = 1; O =16
a) 10 g
b) 20 g
c) 30 g
d) 40 g
e) 50 g
07. (MED – ITAJUBA) Quantos gramas de Na3PO4 (PM = 164) são necessárias para preparar 5,0 litros de uma solução 3 molar?
a) 10,9
b) 65,6
c) 98,4
d) 273
e) 2460
08. (MED – POUSO ALEGRE) Para se preparar um litro de solução de KMnO4 0,1 N que deve atuar como oxidante em meio ácido, são necessários do sal: Dados: K = 39; Mn = 55; O =16
a) 15,8 g
b) 7,9 g
c) 31,6 g
d) 3,16 g
e) 1,58 g
09. (PUC) Foram totalmente dissolvidos em 100 ml de ácido clorídrico 6,54 gramas de zinco. Supondo não haver variação de volume da solução, qual é a molaridade da solução final em cloreto de zinco? Dado: Zn = 65,4
a) 0,1 M
b) 0,2 M
c) 1 M
d) 2 M
e) 10 M
10. (UFPR – UEMT) Uma solução aquosa de determinada concentração foi preparada a 20°C. Na temperatura de 60°C, a sua concentração será exatamente a mesma, somente se for expressa como:
a) normalidade
b) molaridade
c) molalidade
d) fração pondero-volumétrica
e) fração volumétrica
Respostas:
01 -
aproximadamente 106 g de Na2CO3 e 1894 g de H2O
02 - C
|
03 - C
|
04 - C
|
05 - E
| |
06 - E
|
07
- E
|
08
- D
|
09
- C
|
10
- C
|
BOM ESTUDO !!!
Postado por: Kennedy S. e Paulo André


















1. (FAAP) Quais as massas de Na2CO3 e de água, necessárias para preparar 2 kg de uma solução aquosa de carbonato de sódio de concentração igual a 0,5 molal?
ResponderExcluircolegas, a molalidade é a relaçao entre o numero de mols do soluto com a massa do solvente em kilos observe que:
1 mol de Na2CO3 = 106g em 1kg de H20,
Assim temos: a relaçao:
0,5mols -----53g de Na2C03-----1000gde H20-------1053g de solução
entao.... x Na2C03 y H20 2000g de solucao
x= m1= 2000 x 53 / 1053 = 100,67 m1= 100,7g de Na2C03 e,
y= m2= 2000 x 1000/1053 = 1.899,33 m2=1899,66g de H20
note que se voce calcular a molalidade com esses valores: tera.
w= m1
------ = W = 100,67g
m2.Mol -------------- = 0,5 molal.
1,899,33g x 106
espero ter ajudado.
Bet365.ag Casino Review & Bonus | Vie Casino
ResponderExcluirBet365 Casino Review ➜ Read our review and discover vua nhà cái the game selection, 10cric login the games, safety and bet365 reputation of our site.